Bệnh lơ xê mi là gì ? điều trị bệnh lơ xê mi cấp bằng thuốc đích
Bệnh lơ xê mi là gì ? điều trị bệnh lơ xê mi cấp bằng thuốc đích
Từ vài thập kỷ trở lại đây, bệnh nhân mắc các bệnh máu ác tính nằm trong nhóm bệnh nhân thụ hưởng nhiều nhất những tiến bộ của điều trị ung thư. Mặc dù các chương trình điều trị có rất nhiều tiến bộ , khả năng kéo dài cuộc sống có chất lượng cho các bệnh nhân lơ xê mi cấp cũng còn rất hạn chế với tỷ lệ khoảng 20% – 30% đối với lơ xê mi cấp dòng tủy(AML) và khoảng 30% - 40% đối với lơ xê mi cấp dòng lymphô(ALL). Nguyên nhân chủ yếu dẫn đến kết quả trên là tái phát. Thêm vào đó, đa hoá trị liệu tích cực, phương pháp điều trị thông dụng nhất, thường lại đi cùng với tỷ lệ tử vong cao.Yếu tố chính làm tăng cao tỷ lệ tử vong là tác dụng độc lên cả tế bào ác tính lẫn tế bào lành của thuốc hoá chất. Độc tính cao của hoá chất đã hạn chế rất nhiều khả năng điều trị đặc biệt đối với bệnh nhân lớn tuổi. Để hạn chế tác dụng phụ, tăng cao hiệu quả tác dụng chính, hiện nay, các nhà khoa học đã và đang đi theo một phương hướng mới đầy triển vọng trong điều trị ung thư nói chung và điều trị bệnh máu ác tính nói riêng, đó là điều trị nhắm đích(targeting therapy) hay nói cách khác là tìm ra các thuốc chỉ tìm và diệt tế bào ác tính còn không ảnh hưởng đến tế bào lành.
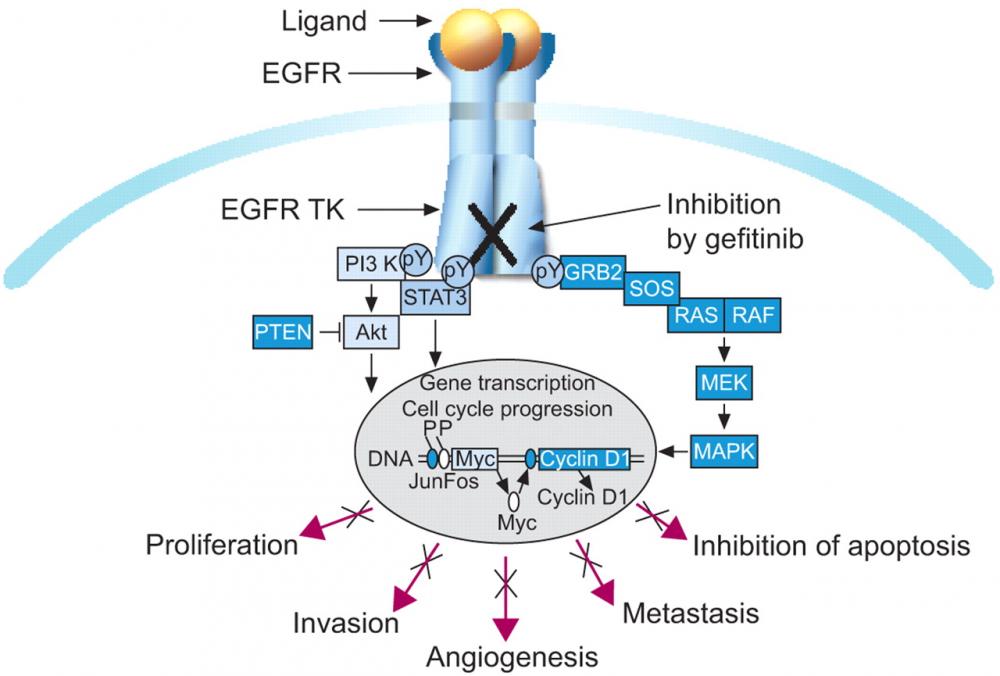
Khái niệm về điều trị nhắm đích đã được các nhà khoa học đưa ra từ nhiều năm trước. Vào năm 1953, Pressman và Korngold đã chứng minh rằng các kháng thể có thể nhắm đích đặc hiệu lên tế bào ung thư(11). Tuy vậy, phải tới năm 1975, khi Kohler và Milstein nhận giải thưởng Nobel cho công trình nghiên cứu của họ về kỹ thuật hybridoma, việc sản xuất kháng thể đơn dòng nhắm đích kháng nguyên đặc hiệu mới bắt đầu đi vào hiện thực (7). Năm 1979, Nadler và cs đã điều trị bệnh nhân u lymphô ác tính đầu tiên bằng kháng thể đơn dòng (9). Ngày nay, có tới trên 3000 bệnh nhân ung thư được điều trị bằng kháng thể đơn dòng. Song song với các nghiên cứu theo hướng điều trị bằng kháng thể đơn dòng, phương pháp điều trị nhắm đích phân tử (molecular targeting theray) cũng được nghiên cứu và phát triển. Phương pháp này được ứng dụng thành công đầu tiên trong điều trị lơ xê mi kinh dòng hạt bằng thuốc ức chế đặc hiệu tyrosine kinase, STI571(signal transduction inhibitor 571)(3).
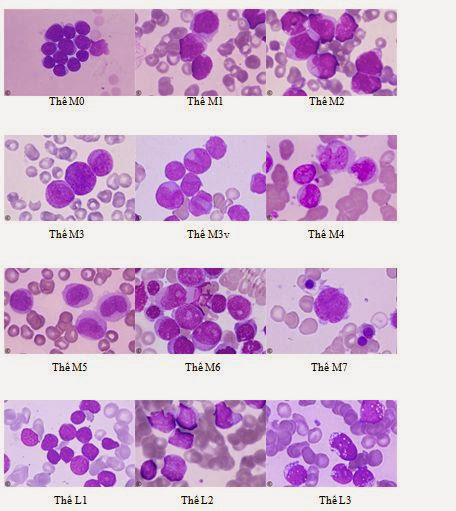
Bệnh Lơ xê mi cấp dòng tủy (AML) là gì
Các thuốc khôi phục lại quá trình biệt hóa và chết theo chương trình
Thành công nhất của phương pháp điều trị nhắm đích phân tử đối với AML chính là ứng dụng all trans retinoic acid(ATRA) trong điều trị lơ xe mi cấp tiền tủy bào(APL). ATRA được sử dụng lần đầu tiên vào năm 1986 và hiện nay trở thành lựa chọn hàng đầu trong điều trị APL (5). Bệnh APL có biến đổi nhiễm sắc thể đặc trưng là chuyển đoạn t(15;17)(q22;q21), dẫn đến sự hình thành tổ hợp gen và prôtêin PML-RARỏ đóng vai trò chủ đạo trong cơ chế bệnh sinh của bệnh. Prôtêin PML có hoạt tính ức chế sự lớn lên cũng như điều hoà quá trình chết theo chương trình của tế bào. Các đặc tính này của PML sẽ bị rối loạn khi tham gia vào tổ hợp PML-RARỏ. Đồng thời, prôtêin PML-RARỏ lại có hoạt tính ức chế quá trình biệt hóa của các tế bào dòng tủy đặc biệt là tiền tủy bào qua các con đường khác nhau: PML-RARỏ kết hợp với receptor x của retinoic (RXR), nuclear corepressors(N-CoR), Sin3A, và histone deacetylase(HDAC) hình thành một tổ hợp có tác dụng kìm hãm quá trình sao chép của gen đích; tác động lên quá trình dẫn truyền tín hiệu của retinoic acid; hình thành một heterodimer với prôtein PML tự do và giải phóng vùng oncogen của PML(PML oncogenic domain- POD)(16). ATRA có khả năng gắn lên receptor RAR khởi động quá trình phá hủy prôtêin PML-RARỏ, tạo điều kiện cho tiền tủy bào tiếp tục biệt hoá đến giai đoạn cuối cùng; khi tế bào APL tiếp xúc với ATRA invitro hoặc invivo sẽ khởi động quá trình xắp xếp lại vị trí của PML và phục hồi cấu trúc bình thường của POD; dưới tác dụng của ATRA với nồng độ dược lý, CoR sẽ giải phóng khỏi tổ hợp nêu trên dẫn đến tác dụng kìm hãm quá trình sao chép của phức hệ này không còn nữa tạo điều kiện cho quá trình biệt hoá của tiền tủy bào được phục hồi. Phác đồ điều trị phối hợp ATRA và đa hoá trị liệu là phác đồ chuẩn hiện nay trong điều trị APL. ATRA kết hợp với đa hóa trị liệu có thể mang lại kết quả khả quan với tỷ lệ lui bệnh hoàn toàn của bệnh nhân APL từ 90%-95% và khả năng lui bệnh kéo dài hay có thể nói cách khác là khỏi bệnh 70%-75%(16). Tác dụng không mong muốn nguy hiểm nhất của ATRA là hội chứng retinoic acid. Một loại dược chất thứ hai cũng rất có hiệu quả trong điều trị APL là arsenic. Arsenic đã được sử dụng từ trên 500 năm trước đây trong y học cổ truyền Trung Quốc. Vào những năm đầu của thập kỷ 70 của thế kỷ 20, một nhóm các nhà khoa học của trường đại học Y khoa Harbin(Trung Quốc) đã thông báo rằng dung dịch nguyên chất của arsenic trioxide(As2O3) có thể dùng để điều trị APL theo nguyên lý dùng độc trị độc của y học cổ truyền Trung Quốc. Từ thời điểm đó, rất nhiều nghiên cứu đã ứng dụng As2O3 trong điều trị APL, đặc biệt là APL tái phát, mang lại những kết quả rất khả quan với tỷ lệ lui bệnh hoàn toàn khoảng 85% - 90%, tỷ lệ sống không bệnh trên 5 năm có thể đạt đến 80%. Theo các nghiên cứu, As2O3 có tác dụng khởi động quá trình chết theo chương trình của các tế bào ung thư theo rất nhiều cơ chế khác nhau. Bên cạnh đó, các tác giả cũng phát hiện ra rằng với một nồng độ thấp hơn của liều điều trị, As2O3 có khả năng biệt hoá một phần các tiền tủy bào theo con đường biệt hoá bình thường của dòng bạch cầu hạt. Hiện nay, một số phác đồ đang trong quá trình nghiên cứu sử dụng phối hợp ATRA và As2O3 và bước đầu mang lại hiệu quả tốt.
Thuốc Vesanoid điều trị Lơ xê mi
Miễn dịch trị liệu – Immunotherapy
Những tiến bộ trong nghiên cứu mức độ phân tử bệnh lơ xê mi cấp đã giúp cho các nhà khoa học tìm ra và ứng dụng nhiều kháng thể đơn dòng chống kháng nguyên đặc hiệu trên bề mặt của tế bào ung thư. Phương pháp điều trị này còn được gọi dưới một tên khác là miễn dịch trị liệu(immunotherapy). Thường có hai khả năng trong sử dụng kháng thể đơn dòng, liên kết và không liên kết. Các kháng thể không liên kết là các kháng thể có khả năng gây độc tế bào trực tiếp qua con đường kích hoạt hệ thống miễn dịch hoạt động hay nói một cách khác, các kháng thể này như một cầu nối giữa các tế bào có thẩm quyền miễn dịch của cơ thể với các tế bào ung thư, tạo điều kiện cho hệ thống miễn dịch tế bào tiêu diệt tế bào ung thư. Đại diện cho nhóm này có thể kể đến rituximab, kháng thể đơn dòng IgG kháng CD20 dùng điều trị các bệnh tăng sinh ác tính dòng tế bào lymphô B, và alemtuzumab, kháng thể đơn dòng kháng CD52 dùng điều trị các bệnh tăng sinh ác tính dòng lymphô như lơ xê mi kinh dòng lymphô, u lymphô ác tính, lơ xê mi tiền lymphô T…. Loại thứ hai là kháng thể đơn dòng liên kết, là một phức hợp gồm kháng thể đơn dòng gắn với một chất có khả năng gây độc hay tiêu diệt tế bào ung thư. Kháng thể đơn dòng trong trường hợp này như một “quả tên lửa” mang “chất nổ” tìm đến đúng tế bào ung thư, chuyển “thuốc nổ” vào trong tế bào để tiêu diệt tế bào. “Chất nổ” ở đây có thể là hoá chất, có thể là chất phóng xạ. Đại diện của nhóm này là gemtuzumab ozogamicin, kháng thể đơn dòng kháng CD33 có gắn thêm hóa chất, 131I-tositumomab, kết hợp kháng thể kháng CD20 với 131I để điều trị u lymphô ác tính tế bào B. Gemtuzumab ozogamicin là kháng thể đơn dòng gắn với calicheamicin (một loại kháng sinh diệt tế bào bằng ức chế quá trình tổng hợp DNA và dẫn đến là tế bào chết theo chương trình), kết nối trực tiếp với kháng nguyên bề mặt CD33 có trên 90% các tế bào non ác tính dòng tủy. Sự kết hợp kháng thể kháng CD33 đơn thuần với kháng nguyên không tạo ra được hiệu quả diệt tế bào như kháng thể kháng CD20. Điều này được giải thích là do lượng kháng thể đưa vào chỉ vừa đủ để gắn lên các điểm kháng nguyên và phức hợp này bị nội bào hóa hết sức nhanh chóng(12). Gemtuzumab ozogamicin đã được FDA cho phép sử dụng trên lâm sàng tại Hoa Kỳ từ tháng 05/2000 với chỉ định cho những trường hợp AML CD33+, trên 60 tuổi, tái phát lần đầu và không có khả năng điều trị tiếp bằng hóa trị liệu tích cực. Tỷ lệ đáp ứng với điều trị của nhóm bệnh nhân này vào khoảng 30%, và 15% đạt lui bệnh hoàn toàn. Các biến chứng hay gặp là sốt rét, tăng men gan và bilirubin, giảm bạch cầu, giảm tiểu cầu…. Một biến chứng nặng có thể gặp ở những bệnh nhân sẽ được ghép tế bào gốc trong vòng 3 – 4 tháng sau khi kết thúc điều trị bằng gemtuzumab ozogamicin là hội chứng giống bệnh tắc tĩnh mạch trên gan(veno-occlusive disease-like syndrome). Khi được sử dụng đơn độc trong điều trị tấn công AML, tỷ lệ đáp ứng điều trị thường thấp 8% - 30%. Tuy nhiên, các nghiên cứu giai đoạn II phác đồ kết hợp gemtuzumab ozogamicin với đa hóa trị liệu tích cực đã cho kết quả rất khả quan với khoảng 85% bệnh nhân AML đáp ứng tốt với điều trị(14). Hiện nay, nhiều nhóm nghiên cứu đa trung tâm như SWOG (Southwest Oncology Group), MRC(Medical Research Council), EORTC (European Organization for Research and Treatment of Cancer )… đang tiến hành nghiên cứu giai đoạn III phác đồ phối hợp gemtuzumab ozogamicin với đa hóa trị liệu điều trị các trường hợp AML mới. Nếu các thử nghiệm lâm sàng này xác nhận kết quả giai đoạn II thì đó sẽ là một tiến bộ vượt bậc và là một bước thay đổi quan trọng trong điều trị AML từ 3 thập kỷ trở lại đây.
Các chất ức chế gen – prôtêin kháng các thuốc
P-glycoprotein là một prôtêin màng tế bào được mã hóa bởi gen MDR1, đóng vai trò như một bơm đẩy thuốc hóa chất ra khỏi tế bào. Nó thường thể hiện đặc biệt ở những người lớn tuổi và ở những bệnh nhân AML tái phát hoặc kháng nhiều loại hóa chất. Kìm hãm hoặc ngăn chặn hoạt động của bơm này là một định hướng trong nghiên cứu phương pháp điều trị mới. Rất nhiều thuốc có khả năng ức chế P-glycoprotein in vitro, nhưng ngoài nghiên cứu của SWOG thử nghiệm phối hợp cyclosporine với cytarabine và daunorubicin trong điều trị bệnh nhân tái phát hoặc kháng thuốc, gần như tất cả các thử nghiệm cyclosporine và PSC-833(non-immunosuppressive cyclosporine analog)trong điều trị bệnh nhân AML đã điều trị hay chưa đều không có hiệu quả và, thậm chí, đôi khi có độc tính cao. Các thuốc thế hệ thứ hai có tác dụng điều chỉnh “chiếc” bơm này như Zosuquidar (LY335979) đang trong giai đoạn nghiên cứu(2). Phác đồ điều trị có Zosuquidar không yêu cầu phải giảm liều hóa chất điều trị phối hợp, một hạn chế mà có ở các thuốc khác như PSC-833.
Các chất ức chế Farnesyl transferase
Farnesylation là một phản ứng hóa sinh cần thiết cho các hoạt động của nhiều phân tử dẫn truyền tín hiệu như RAS…. Farnesyltransferase là một loại men tham gia vào phản ứng trên. Các đột biến của RAS gene xuất hiện cùng với sự phát triển của bệnh lơ xê mi dòng tủy. Các thuốc ức chế Farnesyltransferase(FTI) như tipifarnib can thiệp vào hoạt động dẫn truyền thông tin của RAS bằng cách ngăn phản ứng farnesylation của RAS và quá trình di chuyển đến màng bào tương. FTI có hiệu quả khi sử dụng điều trị cả AML kháng thuốc và AML mới. Đáp ứng điều trị lại không tương quan với sự có mặt của các đột biến của RAS. Đồng thời, đáp ứng điều trị cũng không thực sự cần thiết phải tương quan với mức độ ức chế farnesyltransferase, chứng tỏ có thể có thêm đích khác của thuốc mà chưa tìm ra. Những kết quả nghiên cứu đầu tiên cho thấy tỷ lệ đáp ứng chung vào khoản 34% và tỷ lệ lui bệnh hoàn toàn 17% với tipifarnib đường uống(Zarnestra) trong điều trị 151 bệnh nhân AML mới với tuổi trung bình 73(8). Các kết quả này đã dẫn tới việc khởi động thử nghiệm lâm sàng giai đoạn II của nhóm US Intergroup trial (S0432) với much đích đánh giá Tipifarnib trong điều trị bệnh nhân lớn tuổi không có khả năng điều trị hoá chất tích cực. Nhóm US Intergroup cũng đang tiến hành nghiên cứu thực nghiệm lâm sàng(E2902) đánh giá hiệu quả của Tipifarnib trong điều trị AML tái phát lần 1 hoặc 2 và không có khả năng ghép tế bào gốc tạo máu. Trong nghiên cứu này Tipifarnib được dùng để điều trị duy trì sau khi bệnh nhân đã lui bệnh hoàn toàn và đã được điều trị củng cố. Cả hai nghiên cứu trên S0432 và E2902 đều hy vọng mang lại một số câu trả lời những đầu bài lớn chưa có lời giải trong điều trị AML.
Các chất ức chế histone deacetylase và proteosome
Hiện tượng biến đổi sau sao chép của histone qua phản ứng acetylation xúc tác bởi men histone acetyltransferase tham gia vào quá trình sửa đổi chất nhiễm sắc và hiện tượng im lặng thứ phát của quá trình sao chép. Men histone deacetylases (HDACs) lại có vai trò ngược lại và tham gia vào quá trình phục hồi lại cấu trúc của chất nhiễm sắc. Các chất ức chế HDAC khởi động quá trình biệt hóa của các tế bào non ác tính. Nhiều loại thuốc như suberoylanilide hydroxamic acid(SAHA), valproic acid (2-propylpentanoic acid), depsipeptide và MS-275 là những chế phẩm của các chất ức chế HDAC và đang trong giai đoạn nghiên cứu đánh giá. Nhóm US Intergroup đang tiến hành nghiên cứu thử nghiệm giai đoạn II hiệu quả của MS-275 phối hợp với liều thấp 5-azacytidine trong điều trị hội chứng rối loạn sinh tủy.
Bortezomib, chất ức chế proteosome, có hoạt tính trong lơ xê mi và có cộng hưởng hoạt tính invitro với các chất ức chế HDAC. Hiệu quả của bortezomib phối hợp với đa hóa trị liệu đang được nghiên cứu và đánh giá.
Các chất chống quá trình tân tạo mạch (Antiangiogenesis agents)
Hiện tượng tân tạo mạch(angiogenesis) đóng vai trò quan trọng trong quá trình xuất hiện, phát triển và lan rộng của ung thư. Phân tích tiêu bản sinh thiết tủy xương của các bệnh nhân lơ xê mi cấp cho thấy mật độ các vi mạch tăng cao so với tủy xương bình thường. Các nhà nghiên cứu cũng phát hiện ra rằng mật độ vi mạch trở lại bình thường sau khi bệnh nhân được điều trị hóa chất tích cực và đạt lui bệnh hoàn toàn. Các yếu tố tăng trưởng nội mô mạch (vascular endothelial growth factor -VEGF) là các chất có khả năng kích thích quá trình tăng sinh mạch và vai trò của VEGF đối với hiện tượng tân tạo mạch trong ung thư đã được biết tới từ nhiều năm nay. Bên cạnh đó, VGEF cũng kích thích sự phát triển, tăng sinh của các tế bào lơ xê mi và hiện tượng tăng cao nồng độ nội sinh của VEGF thường được xem là một yếu tố tiên lượng xấu(1). Các VEGF(VEGF-A, -B, -C, -D) hoạt động thông qua các VGEF receptor (VEGFR-1, -2, và -3) có bản chất là các receptor tyrosine kinases. Các tyrosine kinase này bình thường được tìm thấy ở nội mạc mạch là nơi mà chúng tham gia vào quá trình tăng sinh và tồn tại của các tế bào nội mô trong các điều kiện bình thường. Chính vì vậy, việc nghiên cứu và ứng dụng các chất có khả năng ức chế receptor tyrosine kinase của VEGF là một phương hướng mới trong quá trình tìm kiếm các phương pháp điều trị lơ xê mi cấp. Các nghiên cứu đầu tiên gợi ý rằng SU5416, một chất ức chế quá trình phosphorylation của VEGF receptors 1 và 2, C - KIT, SCF receptor và FLT3, có hiệu quả trong điều trị AML (4) Bevacizumab, một loại kháng thể kháng VEGF, đã được sử dụng an toàn cho các bệnh nhân AML sau đa hoá trị liệu. Trong nghiên cứu giai đoạn II, bevacizumab được chỉ định vào ngày thứ 8 sau khi kết thúc liệu trình cytarabin liều cao phối hợp với mitoxantrone điều trị các bệnh nhân AML tái phát hoặc kháng thuốc: tỷ lệ đáp ứng chung 48%, tỷ lệ lui bệnh hoàn toàn 33% và tỷ lệ tử vong 15%. (6).
Các chất ức chế FLT3 và các tyrosine kinase khác
FLT3 là receptor tyrosine kinase tương tự như KIT, FMS và PDGFR. Những đột biến của FLT3 xuất hiện ở khoảng 30% bệnh nhân AML. FLT3 có mặt trên bề mặt tế bào lơ xê mi của phần lớn bệnh nhân AML và ALL tế bào B. Đối với các tế bào lơ xê mi có FLT3, mối liên kết FLT3-ligand có thể kích thích quá trình tăng sinh tế bào và giảm quá trình chết theo chương trình apoptosis. Các đột biến FLT3 được coi như một yếu tố tiên lượng xấu. Các nghiên cứu về FLT3 đã thúc đẩy phát triển các chất ức chế lựa chọn FLT3 receptor kinase có khả năng diệt tế bào lơ xê mi invitro. Bốn chất ức chế FLT3 đang trong quá trình nghiên cứu thử nghiệm lâm sàng: PKC-412 (Novartis), CEP-701 (Cephalon), MLN518 (Millennium) and SU11248 (SuGen)(14) Kết quả bước đầu cho thấy các chất này ức chế thành công FLT3 với liều chấp nhận được cho bệnh nhân. Các chất ức chế này có tác dụng trong trường hợp bệnh nhân AML có đột biến, tái phát. Tuy nhiên, các đáp ứng trên lâm sàng cũng còn rất hạn chế. Nhìn chung, chỉ quan sát thấy biểu hiện giảm tạm thời blasts máu ngoại vi và tủy xương. Theo kết quả của một nghiên cứu mới đây, có 40/57(70%) bệnh nhân có biểu hiện giảm khoảng 50% lượng tế bào blasts máu ngoại vi, và 6 bệnh nhân có giảm 50% blasts trong tủy xương(13). Các nghiên cứu hiện nay đang tập trung vào thử nghiệm điều trị phối hợp chất ức chế FLT3 với đa hóa trị liệu.
Lơ xê mi cấp dòng lymphô(ALL)
Kết quả điều trị ALL người lớn đã có những tiến bộ vượt bậc trong những năm gần đây nhờ vào việc ứng dụng các phác đồ hóa trị liệu mạnh, ghép tế bào gốc và các biện pháp điều trị hỗ trợ hiện đại. Bên cạnh đó, các nhà khoa học cũng đang nghiên cứu tìm tòi các biện pháp điều trị khác hữu hiệu hơn hoá trị liệu tích cực ví dụ như điều trị nhắm đích phân tử với chất ức chế men kinase (imatinib mesylate), và các kháng thể đơn dòng. Các thử nghiệm trên đã mang lại một số kết quả khích lệ tuy vẫn còn nhiều hạn chế khi sử dụng imatinib điều trị cho các bệnh nhân ALL có Ph1+. Chuyển đoạn BCR-ABL là một biểu hiện bất thường nhiễm sắc thể thường gặp ở các bệnh nhân ALL, chiếm tỷ lệ 20% - 30%, đặc biệt rất hay gặp ở thể ALL tiền B(c-ALL, pre B-ALL). Hiệu quả điều trị tăng lên rõ rệt khi kết hợp imatinib với các phương pháp hóa trị liệu kinh điển. Hiện nay, các nghiên cứu đang tập trung theo hướng sử dụng phác đồ phối hợp trên để điều trị cho các bệnh nhân ALL Ph1+ có các yếu tố tiên lượng xấu. Theo kết quả nghiên cứu giai đoạn II của Ottmann OG và cs thực hiện đối với 48 bệnh nhân ALL Ph1+ tái phát hoặc kháng thuốc, khoảng 60% bệnh nhân có đáp ứng về huyết học với tỷ lệ lui bệnh hoàn toàn 15% và thời gian sống thêm toàn bộ khoảng 05 tháng(10). Các tế bào bạch cầu cũng như bạch cầu lymphô trưởng thành trong bệnh ALL, cũng như u lymphô Burkitt, thường thể hiện CD20+. Cũng tương tự như đối với u lymphô ác tính tế bào B CD20+ , nhiều nghiên cứu hiện nay đang tiến hành thử nghiệm sử dụng rituximab(kháng thể đơn dòng kháng CD20) điều trị ALL CD20+. Theo một nghiên cứu của Thomas DA và cs, các tác giả đã đạt được tỷ lệ lui bệnh hoàn toàn 89% khi thực hiện phác đồ phối hợp rituximab với đa hóa trị liệu tích cực hyper-CVAD điều trị các bệnh nhân nhóm Burkitt lymphoma/leukemia(15) Các kháng thể đơn dòng nhắm đích các kháng nguyên bề mặt khác như CD19, CD22, CD25, và CD52, sử dụng đơn thuần hay phối hợp với đa hóa trị liệu hiện đang trong giai đoạn nghiên cứu và đã cho một số kết quả khích lệ.
Tài liệu tham khảo
- Aguayo A, Estey E, Kantarjian H, et al. Cellular vascular endothelial growth factor is a predictor of outcome in patients with acute myeloid leukemia. Blood 1999; 94:3717-21
- Cripe L, Tallman M, Karanes C, et al. A phase II trial Zosuquidar (LYSS5979), a modulator of P-glycoprotein (Pgp), plus daunorubicin and high-dose cytarabine in patients with newly-diagnosed secondary acute myeloid leukemia(AML) refractory anemia with excess blasts in transfermation (RAEB-t) or relapsed (refractory) AML[abstract]. Blood 2001;98:595a
- Drucker BJ, Talpaz M, Resta DJ et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Eng J Med 2001;344:1031-1037
- Fiedler W, Mesters R, Tinnefeld H, et al. A phase 2 clinical study of SU5416 in patients with refractory acute myeloid leukemia. Blood. 2003;102:2763-2767
- Huang ME, Ye YC, Wang ZY. Treatment of 4 APL patients with all trans retinoic acid. Chin J Intern Med 1987;26:330-332
- Karp JE, Gojo I, Pili R, et al. Targeting vascular endothelial growth factor for relapsed and refractory adult acute myelogenous leukemias: therapy with sequential 1-beta-darabinofuranosylcytosine, mitoxantrone, and bevacizumab. Clin Cancer Res. 2004;10:3577-3585
- Kohler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975;256:495-497
- Lancet JE, Gotlib J, Gojo I, et al. Tipifarnib (ZARNESTRA™) in previously untreated poor-risk AML of the elderly: updated results of a multicenter phase 2 trial. Blood 2004; 104:249a (abstract 874
- Nadler LM, Stashenko P, Hardy R et al. Serotherapy of a patient with a monoclonal antibody directed against a human lymphoma-associated antigen. Cancer Res 1980;40:3147-3154
- Ottmann OG, Druker BJ, Sawyers CL, Rei€ers J,O'Brien SG, Goldman JM et al. Results of a phase II study to determine the safety and anti-leukemic effects of STI571 in adult patients with advanced Philadelphia chromosome +ve leukemias. Blood 2000; 96: abstract
- Pressman D, Korngold L. The invivo localization of anti-Wagner osteogenic sarcoma antibody. Cancer 1953;6:619-623
- Radich J, Sievers EL. New developments in the treatment of acute myeloid leukemia. Oncology 2000;14:125-131
- Stone RM, DeAngelo DJ, Klimek V, et al. Patients with acute myeloid leukemia and a deteriorating mutation in FLT3 response to a small molecule FLT3 tyrosine kinase inhibitor PKC412. Blood. 2005; (E-pub Ahead of Print)
- Tallman MS. New strategies for the treatment of AML including antibodies and other novel agents. Hematology 2005:143-150
- Thomas DA, Cortes J, Giles FJ et al. Rituximab and hyper-CVAD for adult Burkitt’s (BL) or Burkitt’s Like (BL) leukemia or lymphoma. Blood. 2002;100:763a. Abstract.
- Zhen-yi Wang. Treatment of AML by inducing differentiation and apoptosis. Hematology 2003:1-13