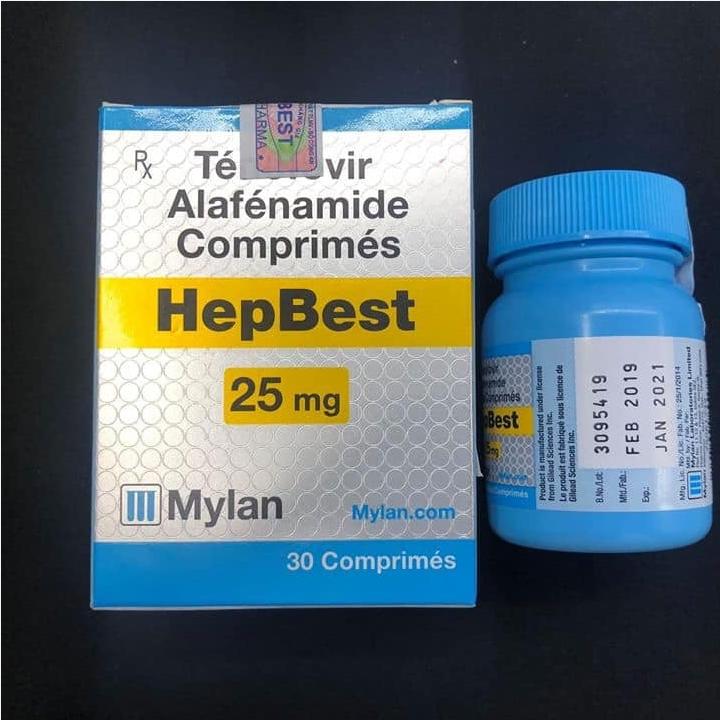
Thuốc Hepbest thuốc điều trị viêm gan B mới nhất
Thuốc Hepbest chứa hoạt chất tenofovir alafenamide. Tenofovir alafenamide, một chất ức chế men sao chép ngược nucleoside viêm gan B (HBV), được chuyển đổi thành tenofovir, một nucleoside phosphonate (nucleotide) không đồng dạng của adenosine 5'-monophosphate.
Mỗi viên có 25 mg tenofovir alafenamide (tương đương với 28 mg tenofovir alafenamide fumarate).
Thành phần tá dược gồm có: croscarmellose natri, lactose monohydrat, magiê stearat, và cellulose vi tinh thể. Các viên thuốc được tráng phim với chất phủ bao gồm: sắt oxit màu vàng, polyethylene glycol, rượu polyvinyl, talc, và titanium dioxide.
Tên hóa học của chất tenofovir alafenamide fumarate là L-alanin, N (S) - [[(1R) -2- (6-amino-9H-purin-9-YL) -1-metylethoxy] metyl] phenoxyphosphinyl] -, este 1 metyl etyl, (2E) -2-butenedioat (2: 1).
Nó có công thức thực nghiệm của C21H29O5N6P • ½ (C4H4O4) và trọng lượng của công thức là 534.50.
Thuốc Hepbest chỉ định cho bệnh nhân nào?
Thuốc Hepbest được chỉ định để điều trị bệnh viêm gan B mạn tính ở người lớn bị bệnh gan hoặc xơ gan còn bù.
Thuốc Hepbest được sử dụng như thế nào?
Trước khi bắt đầu điều trị bằng HEPBEST, bệnh nhân cần được kiểm tra nhiễm HIV-1. Không nên sử dụng thuốc Hepbest ở những bệnh nhân nhiễm HIV
Cần đánh giá creatinine huyết thanh, phốt pho huyết thanh, độ thanh thải creatinin ước lượng, glucose trong nước tiểu và protein nước tiểu trước khi bắt đầu dùng thuốc Hepbest và trong suốt quá trình điều trị ở tất cả các bệnh nhân phù hợp về mặt lâm sàng.
Liều dùng khuyến cáo ở người trưởng thành
Liều dùng được khuyến cáo của thuốc Hepbest là 25 mg (một viên) uống một lần một lần mỗi ngày với thức ăn
Liều dùng cho bệnh nhân suy thận
Không điều chỉnh liều lượng thuốc Hepbest ở bệnh nhân suy thận nhẹ, trung bình hoặc nặng. Không nên dùng thuốc Hepbest ở những bệnh nhân có bệnh thận giai đoạn cuối (độ thanh thải creatinin ước tính dưới 15 mL / phút)
Liều dùng thuốc tenofovir alafenamide 25mg cho bệnh nhân suy gan
Không điều chỉnh liều lượng thuốc Hepbest ở bệnh nhân suy gan nhẹ (Child-Pugh A). Không nên dùng thuốc Hepbest ở những bệnh nhân suy giảm chức năng gan suy gan (Child-Pugh B hoặc C)
Phân biệt thuốc Hepbest chính hãng và thuốc Hepbest xách tay
Hiện nay, trên thị trường tồn tại 2 dòng thuốc Hepbest 25mg, về bản chất chúng đều có thành phần hoạt chất giống nhau là Tenofovir alafenamide 25mg, tuy nhiên một dòng được nhập khẩu chính hãng còn một dòng thuốc thì được nhập theo đường xách tay về Việt Nam. Vì vậy giá thành của 2 loại thuốc cũng khác nhau (thường thì thuốc chính hãng giá cao hơn thuốc xách tay do có đầy đủ tem nhập khẩu và nguồn gốc rõ ràng). Để quý bệnh nhân dễ phân biệt 2 loại thuốc chúng tôi xin phép được so sánh như sau:
Với thuốc Hepbest chính hãng: Thuốc Hepbest chính hãng hiện tại được nhập khẩu và phân phối bởi 2 công ty là công ty dược Đa Lê và công ty dược Phương Nghi. Vì vậy thuốc Hepbest chính hãng luôn có tem nhập khẩu của một trong 2 công ty là công ty Đa Lê và công ty Phương Nghi

Thuốc hepbest chính hãng phân phối bởi Đa Lê

Thuốc Hepbest chính hãng phân phối bởi Phương Nghi
Với thuốc Hepbest xách tay: Thuốc Hepbest xách tay không được công ty nào ở Việt Nam nhập khẩu chính thức nên trên hộp thuốc không có tem phụ tiếng Việt và không có tem nhập khẩu
Thuốc Hepbest xách tay
Thuốc hepbest xách tay có hiệu quả điều trị như thuốc Hepbest chính hãng nhưng không được nhập khẩu chính thức về Việt Nam, vì vậy thuốc hepbest xách tay không có tem nhập khẩu trên vỏ hộp.

Để được tư vấn kỹ hơn về thuốc Hepbest 25mg trong điều trị viêm gan B. Quý bệnh nhân có thể liên hệ với chúng tôi theo số điện thoại: 0906297798 để được DSĐH tư vấn
Bảo quản:
Viên thuốc Hepbest chứa 25 mg tenofovir alafenamide. Mỗi chai chứa 30 viên (NDC 61958-2301-1), một chất làm khô bằng silica gel, cuộn polyester, và được đóng lại bằng bao đóng trẻ em.
Bảo quản dưới 30 ° C (86 ° F).
Tác dụng phụ của thuốc Hepbest 25mg
Các phản ứng phụ sau đây được thảo luận trong các phần khác của ghi nhãn:
Sốt Lactic / Hepatomegaly nặng nề với Steatosis
Sự khởi phát mới hoặc tồi tệ hơn của suy thận
Kinh nghiệm thử nghiệm lâm sàng
Do các thử nghiệm lâm sàng được tiến hành dưới các điều kiện khác nhau, tỷ lệ phản ứng bất lợi được quan sát trong các thử nghiệm lâm sàng của một loại thuốc không thể so sánh trực tiếp với tỷ lệ trong các thử nghiệm lâm sàng của một loại thuốc khác và có thể không phản ánh tỷ lệ được thấy trong thực tế.
Phản ứng bất lợi Trong Đối tượng người lớn có Viêm gan B mãn tính và Bệnh gan còn bù
Đánh giá an toàn của Hepbest được dựa trên dữ liệu tổng hợp thông qua phân tích dữ liệu 48 tuần từ 1298 đối tượng trong hai nghiên cứu ngẫu nhiên, mù đôi, thử nghiệm có kiểm soát chủ động, nghiên cứu 108 và nghiên cứu 110 ở những người trưởng thành bị viêm gan loại B mãn tính và bệnh gan bù. Tổng cộng có 866 đối tượng đã được uống tenofovir alafenamide 25 mg x 1 lần / ngày
Tỷ lệ những người ngừng điều trị bằng tenofovir disoproxil fumarate do phản ứng bất lợi của mức độ nghiêm trọng là 1,0% và 1,2%. Bảng 1 cho thấy tần suất phản ứng bất lợi (tất cả các lớp) lớn hơn hoặc bằng 5% trong nhóm dùng Hepbest
Trong nghiên cứu 108 và 110 đối với người lớn mắc bệnh viêm gan B mãn tính và eGFR cơ bản trung bình là 106 và 105 mL / phút (đối với nhóm TDF), creatinine huyết thanh trung bình tăng ít hơn hơn 0.1 mg / dL và phosphor huyết thanh trung bình giảm 0.1 mg / dL ở cả hai nhóm điều trị. Thay đổi trung bình từ đường cơ sở trong eGFR là -1,2 mL / phút trong nhóm VEMLIDY và -5,4 mL / phút ở những người nhận TDF. Ý nghĩa lâm sàng lâu dài của những thay đổi trong phòng thí nghiệm này đối với tần suất phản ứng bất lợi giữa VEMLIDY và TDF không được biết.
Giảm mật độ khoáng xương
Trong một phân tích tổng hợp của nghiên cứu 108 và 110, tỷ lệ phần trăm thay đổi mật độ xương (BMD) từ ban đầu đến tuần 48 được đánh giá bằng phương pháp hấp thu X quang năng lượng kép (DXA) là -0,6% với thuốc hepbest so với -2,4% với TDF ở cột sống thắt lưng và -0,2% so với -1,9% ở tổng hông. Giảm BMD từ 5% trở lên ở cột sống thắt lưng có 6% đối tượng thuốc hepbest và 20% đối tượng TDF. Giảm BMD từ 7% trở lên ở cổ đùi bằng 3% đối tượng thuốc hepbest và 6% đối tượng TDF. Ý nghĩa lâm sàng lâu dài của những thay đổi BMD này không được biết đến
Bất thường trong phòng thí nghiệm
Tần suất các bất thường trong phòng thí nghiệm (Lớp 3-4) xảy ra ở ít nhất 2% đối tượng được thuốc hepbest trong các nghiên cứu 108 và 110 được trình bày trong Bảng 2.
Bảng 2: Các bất thường trong phòng thí nghiệm (các lớp 3-4) Đã báo cáo ≥ 2% đối tượng bị nhiễm HBV mãn tính và bệnh gan bổ gan trong các nghiên cứu 108 và 110 (tuần 48)
Thông số phòng xét nghiệm bất thường khi dùng tenofovir alafenamide
(N = 866) Tenofovir Disoproxil Fumarate
(N = 432)
ALT (> 5 x ULN) 8% 9%
Glycosuria (≥ 3+) 5% 1%
LDL-cholesterol (ăn chay) (> 190 mg / dL) 4% <1%
AST (> 5 x ULN) 3% 5%
Creatine Kinase (≥ 10 x ULN) 3% 3%
Amylase huyết thanh (> 2,0 x ULN) 3% 2%
Thận trọng những gì khi dùng thuốc Hepbest
Sốt Lactic / Hepatomegaly Đau nặng với Steatosis
Nhiễm Acid lactic và gan tụy nặng với chứng nhiễm mỡ, kể cả trường hợp tử vong, đã được báo cáo với việc sử dụng chất tương tự nucleoside, bao gồm tenofovir disoproxil fumarate kết hợp với các thuốc kháng retrovirus khác. Phần lớn những trường hợp này ở phụ nữ. Béo phì và tiếp xúc với nucleoside kéo dài có thể là những yếu tố nguy cơ. Cần thận trọng đặc biệt khi dùng các chất tương tự nucleoside cho bất kỳ bệnh nhân nào có các yếu tố nguy cơ đã biết về bệnh gan; tuy nhiên, các trường hợp cũng đã được báo cáo ở những bệnh nhân không có các yếu tố nguy cơ đã biết. Việc điều trị bằng thuốc Hepbest nên được đình chỉ ở bất cứ bệnh nhân nào phát triển lâm sàng hoặc xét nghiệm có biểu hiện triệu chứng axit lactic hoặc bị nhiễm độc gan (có thể bao gồm gan và nhiễm mỡ thậm chí khi không có dấu hiệu tăng transaminase).
Chứng Viêm Gây Viêm Gan Cấp C nghiêm trọng sau khi Ngưng Điều Trị
Việc ngừng dùng thuốc chống viêm gan loại B, kể cả thuốc Hepbest, có thể dẫn đến viêm gan siêu vi cấp nghiêm trọng. Những bệnh nhân ngưng dùng thuốc Hepbest cần được theo dõi chặt chẽ với cả việc theo dõi lâm sàng và xét nghiệm trong ít nhất vài tháng sau khi ngừng điều trị. Nếu thích hợp, việc tiếp tục điều trị chống viêm gan B có thể được bảo đảm.
Nguy cơ phát triển kháng HIV-1 ở bệnh nhân đồng nhiễm HBV và HIV-1
Do nguy cơ phát triển kháng HIV-1, nên không dùng thuốc Hepbest để điều trị nhiễm HIV-1. Tính an toàn và hiệu quả của thuốc Hepbest chưa được xác định trên bệnh nhân đồng nhiễm HBV và HIV-1. Xét nghiệm kháng thể HIV nên được cung cấp cho tất cả bệnh nhân nhiễm HBV trước khi bắt đầu điều trị bằng hepbest, và nếu dương tính, nên sử dụng một phác đồ kết hợp kháng retrovirus thích hợp cho bệnh nhân đồng nhiễm HIV-1.
Sự suy giảm chức năng thận khởi phát hoặc trầm trọng hơn
Đã có báo cáo về sự suy giảm chức năng thận, bao gồm các trường hợp suy thận cấp và hội chứng Fanconi (tổn thương ống thận với tràn dịch màng phổi nặng), với việc sử dụng chất proofine tenofovir trong cả nghiên cứu độc tính động vật và thử nghiệm trên người. Trong các thử nghiệm lâm sàng của Hepbest, không có trường hợp nào của hội chứng Fanconi hoặc bệnh thận thận thượng thận (PRT).
Các bệnh nhân dùng chất chống oxy hoá tenofovir có suy giảm chức năng thận và những người dùng thuốc độc thận, kể cả các thuốc chống viêm không steroid, có nguy cơ tăng các phản ứng phụ liên quan đến thận
Cần đánh giá creatinine huyết thanh, phốt pho huyết thanh, độ thanh thải ước tính creatinine, glucose trong nước tiểu và protein nước tiểu trước khi bắt đầu dùng Hepbest và trong suốt quá trình điều trị ở tất cả các bệnh nhân phù hợp về mặt lâm sàng. Ngừng Hepbest ở những bệnh nhân phát triển lâm sàng đáng kể làm giảm chức năng thận hoặc bằng chứng của hội chứng Fanconi.
Thông tin Tư vấn Bệnh nhân
Thông báo cho bệnh nhân đọc nhãn bệnh nhân được FDA phê duyệt (THÔNG TIN BỆNH NHÂN).
Sốt Lactic và Hepatomegaly nặng
Thông báo cho bệnh nhân biết rằng acid lactic lactic và gan tụy nặng với chứng nhiễm mỡ, kể cả trường hợp tử vong, đã được báo cáo khi sử dụng các thuốc tương tự như Hepbest. Thông báo cho bệnh nhân liên hệ ngay với nhà cung cấp dịch vụ y tế của họ và dừng Hepbest nếu họ có các triệu chứng lâm sàng gợi ý nhiễm toan lactic hoặc chứng gan nhiễm độc
Chứng Viêm Gây Viêm Gan Cấp nghiêm nghiêm trọng Sau khi Ngưng Điều Trị
Thông báo cho bệnh nhân rằng ngừng điều trị chống viêm gan B, kể cả Hepbest, có thể gây viêm gan B cấp nặng. Đề nghị bệnh nhân không ngừng Hepbest mà không thông báo trước với nhà cung cấp dịch vụ y tế của họ.
Nguy cơ phát triển kháng HIV-1 ở bệnh nhân đồng nhiễm HIV-1
Thông báo với bệnh nhân rằng nếu họ có hoặc phát triển nhiễm HIV và không điều trị HIV hiệu quả, Hepbest có thể làm tăng nguy cơ phát triển sức đề kháng với thuốc HIV
Sự suy giảm chức năng thận khởi phát hoặc trầm trọng hơn
Thông báo cho bệnh nhân rằng suy thận, kể cả trường hợp suy thận cấp, đã được báo cáo liên quan đến việc sử dụng các chất proofine tenofovir
Tương tác thuốc
Thông báo cho bệnh nhân báo cáo với nhà cung cấp dịch vụ chăm sóc sức khoẻ của họ về việc sử dụng bất kỳ loại thuốc kê toa hoặc thuốc kê toa nào khác, trong đó có thuốc chích của St. John, vì Hepbest có thể tương tác với các thuốc khác.
Liều dùng Không được sử dụng
Thông báo với bệnh nhân rằng cần phải uống Hepbest theo liều thường dùng với thức ăn và để tránh liều lượng thiếu, vì nó có thể gây ra sự đề kháng
Dự định mang thai
Thông báo cho bệnh nhân rằng có dự định mang thai chống retrovirus để theo dõi thai nhi của phụ nữ mang thai tiếp xúc với VEMLIDY
Thuốc Hepbest mua ở đâu?
Địa chỉ mua thuốc Hepbest:
Số 45C Ngõ 143/34 Nguyễn Chính Hoàng Mai Hà Nội
Hoặc: TK22 Nguyễn Cảnh Chân, Quận 1 Thành phố Hồ Chí Minh
Đặt hàng: 0972945305/ Tư vấn Dược sĩ Đại Học: 0906297798
Thuốc Hepbest giá bao nhiêu?
Giá thuốc hepbest: 800.000/ hộp (30 viên)
CÁCH PHÒNG NGỪA VIÊM GAN B LÂY NHIỄM TỪ “MẸ” SANG “CON”
1. Nguy cơ lây nhiễm
- Người mẹ có HBsAg (+) có khả năng lây nhiễm VGB cho con là 90% nếu không dùng thuốc và tiêm chủng chủ động.
- Tuy nhiên nguy cơ giảm đáng kể khi các bà mẹ được sàng lọc viêm gan B,tiêm vaccine cho tất cả các trẻ sơ sinh và sử dụng Globulin miễn dịch dự phòng (HBIG).
- Một nghiên cứu 9252 đứa trẻ sinh ra từ bà mẹ có HBsAg dương tính, 95% trẻ sơ sinh được tiêm phòng vaccine VGB và HBIG trong 12h sau sinh và tiêm đủ 3 liều vaccine VGB sau đó, kết quả chỉ có 1,1% trẻ sơ sinh bị nhiễm VGB. Các yếu tố ảnh hưởng: Mẹ có HBeAg dương tính, nồng độ HBV DNA cao >2.10^3 copsi/ml, trẻ nhận <3 liều vaccine VGB.
Hiệu quả cao của tiêm chủng sơ sinh cho thấy đường lây truyền chủ yếu từ dịch tiết của mẹ và máu trong ống sinh sản tiếp xúc với màng nhầy của trẻ so sinh. Một nghiên cứu ở Trung Quốc chỉ ra rằng chỉ 3,7% trẻ bị lây nhiễm khi trẻ ở trong tử cung.
2. Yếu tố nguy cơ lây truyền:
- Các yếu tố nguy cơ quan trọng nhất lây truyền từ mẹ sang con ( mặc dù đã tiêm HBIG và tiêm vaccine trong 12h sau sinh) là: HBeAg dương tính và nồng độ HBV DNA cao ở người mẹ
- Sinh mổ: Lợi ích việc sinh mổ trong việc bảo vệ chống lại lây nhiễm HBV chưa xác định trong các thử nghiệm. Vì vậy việc sinh mổ không được khuyến cáo thường xuyên đê giảm tỷ lệ lây nhiễm HBV.
- Nuôi con bằng sữa mẹ và lây truyền -: Việc truyền HBV qua cho con bú là không thể, đặc biệt ở trẻ sơ sinh được tiêm vắc-xin HBIG và viêm gan B khi sinh.
3. Đề phòng lây nhiễm từ mẹ sang con
- Xét nghiệm HBsAg nên được thực hiện ở tất cả phụ nữ ở lần khám thai đầu tiên và có thể lập lại ở phụ nữ có nguy cơ cao.
+ Nếu mẹ có HBsAg dương tính, làm thêm xét nghiệm HBV DNA, HBeAg, anti HBe, men gan (GOT,GPT).Nếu có men gan tăng, HBV DNA >10^6 copsi/ml, HBeAg(+) nên đi khám bác sĩ về gan hoặc truyền nhiễm để xem xét dùng thuốc kháng virus. Nên xét nghiệm cho các đứa trẻ khác trong gia đình.
+ Nếu HBV DNA thấp trong tam cá nguyệt đầu tiên hoặc chưa có chỉ định điều trị thuốc ngay, nên xét nghiệm lại HBV DNA lúc thai được 26 đến 28 tuần, nếu tăng xét điều trị. Điều trị nên bắt đầu vào tam cá nguyệt thứ 3 để có đủ thời gian giảm lượng HBV DNA.
- Thuốc điều trị: Tenofovir disoproxil fumarate 300mg/ngày được khuyến cáo vì an toàn cho thai nhi và tỷ lệ kháng thuốc thấp ( chú ý giảm liều cho BN suy thận). Nếu chỉ sử dụng thuốc với mục đích giảm tỷ lệ lây HBV cho con, thuốc có thể ngừng sau khi sinh. Đối với những người tiếp tục điều trị bằng thuốc kháng vi-rút sau khi sinh (ví dụ, để điều trị HBV mạn tính), các rủi ro và lợi ích của việc cho con bú phải được thảo luận với người mẹ.
- Trẻ sơ sinh có mẹ HBsAg dương tính nên được tiêm phòng vaccine VGB và huyết thanh HBIG trong vòng 12 giờ sau sinh và hoàn thành đủ các mũi vaccine viêm gan B theo chương trình tiêm chủng mở rộng.
Tác giả bài viết: Dược sĩ Đỗ Thế Nghĩa, Đại Học Dược Hà Nội
Bài viết có tham khảo thông tin từ website: https://www.drugs.com/cdi/tenofovir-alafenamide.html