Lượt xem: 15120
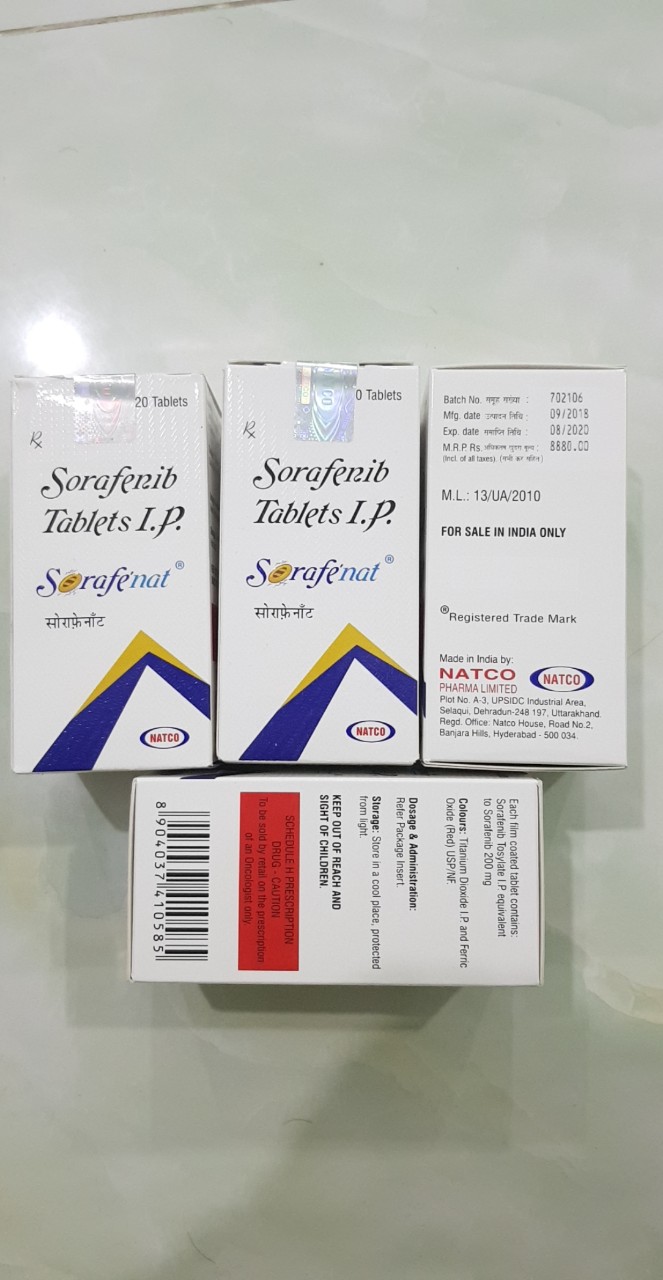
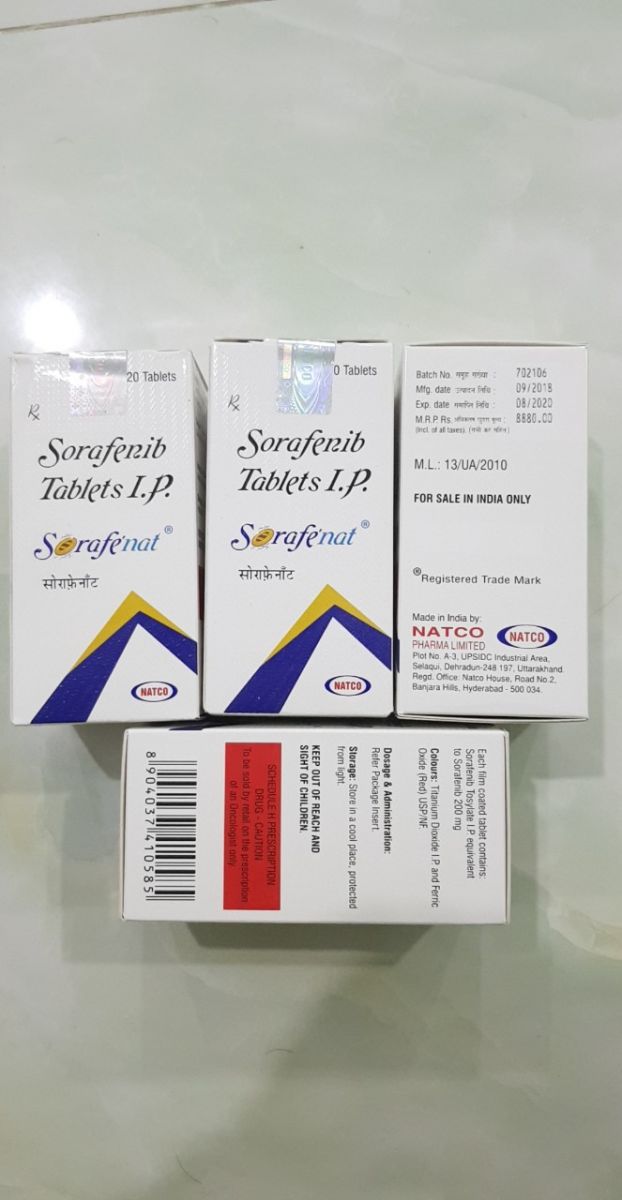
Thuốc Sorafenib 200mg, Thuốc Sorafenat điều trị ung thư gan, thận những thông tin cần biết
Mã sản phẩm : 1521793090
Sorafenib (đồng phát triển và đồng sản xuất bởi Bayer và Onyx Pharmaceuticals như Nexavar), là một thuốc ức chế kinase được chấp thuận để điều trị ung thư thận nguyên phát (ung thư tế bào thận tiên tiến, ung thư biểu mô tế bào tiên tiến tiên phát (carcinoma tế bào gan) và ung thư biểu mô tuyến giáp tiên phát kháng iốt phóng xạ. Tư vấn: 0906297798 - Hà Nội: 45c, ngõ 143/34 Nguyễn Chính, Hoàng Mai, Hà Nội - HCM: 184 Lê Đại Hành, phường 12, quận 11 Tư vấn: 0906297798 Đặt hàng: 0972945305