Lượt xem: 147
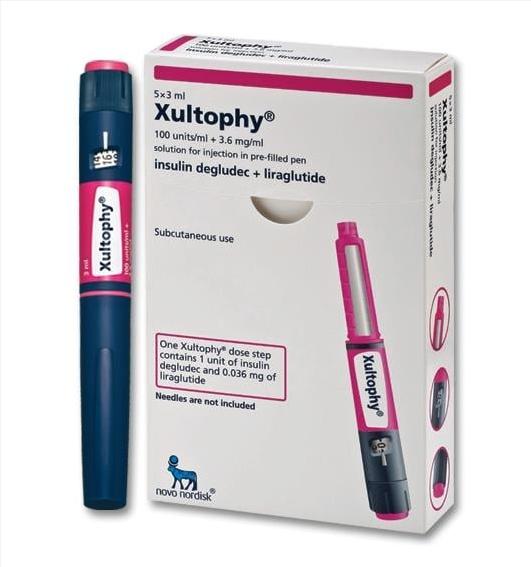
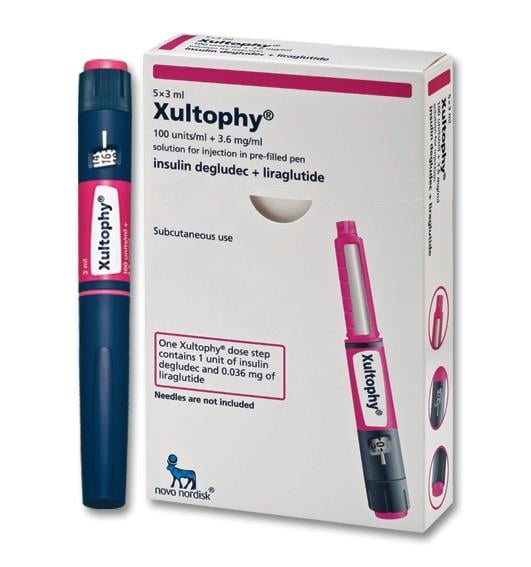
Thuốc Xultophy điều trị tiểu đường giá bao nhiêu
Mã sản phẩm : 1721969605
Thuốc Xultophy 100 / 3.6 (insulin degludec và liraglutide) tiêm 100 đơn vị / ml và 3,6 mg / ml là sự kết hợp của insulin degludec và liraglutide và được chỉ định là thuốc bổ trợ cho chế độ ăn uống và tập thể dục để cải thiện kiểm soát đường huyết ở người lớn bị đái tháo đường loại 2.